quarta-feira, 5 de outubro de 2011
Ligações químicas - 1 ano - Química
Os átomos dificilmente ficam sozinhos na natureza. Eles tendem a se unir uns aos outros, formando assim tudo o que existe hoje.
Alguns átomos são estáveis, ou seja, pouco reativos. Já outros não podem ficar isolados. Precisam se ligar a outros elementos. As forças que mantêm os átomos unidos são fundamentalmente de natureza elétrica e são chamadas de Ligações Químicas.
Toda ligação envolve o movimento de elétrons nas camadas mais externas dos átomos, mas nunca atinge o núcleo.
ESTABILIDADE DOS GASES NOBRES
De todos os elementos químicos conhecidos, apenas 6, os gases nobres ou raros, são encontrados na natureza na forma de átomos isolados. Os demais se encontram sempre ligados uns aos outros, de diversas maneiras, nas mais diversas combinações.
Os gases nobres são encontrados na natureza na forma de átomos isolados porque eles têm a última camada da eletrosfera completa, ou seja, com 8 elétrons. Mesmo o hélio, com 2 elétrons, está completo porque o nível K só permite, no máximo, 2 elétrons.
Regra do Octeto – Os elementos químicos devem sempre conter 8 elétrons na última camada eletrônica ou camada de valência. Na camada K pode haver no máximo 2 elétrons. Desta forma os átomos ficam estáveis, com a configuração idêntica à dos gases nobres.
Observe a distribuição eletrônica dos gases nobres na tabela a seguir:
| NOME | SÍMBOLO | Z | K | L | M | N | O | P | Q |
| HÉLIO | He | 2 | 2 | - | - | - | - | - | - |
| NEÔNIO | Ne | 10 | 2 | 8 | - | - | - | - | - |
| ARGÔNIO | Ar | 18 | 2 | 8 | 8 | - | - | - | - |
| CRIPTÔNIO | Kr | 36 | 2 | 8 | 18 | 8 | - | - | - |
| XENÔNIO | Xe | 54 | 2 | 8 | 18 | 18 | 8 | - | - |
| RADÔNIO | Rn | 86 | 2 | 8 | 18 | 32 | 18 | 8 | - |
A estabilidade dos gases nobres deve-se ao fato de que possuem a última camada completa, ou seja, com o número máximo de elétrons que essa camada pode conter, enquanto última. Os átomos dos demais elementos químicos, para ficarem estáveis, devem adquirir, através das ligações químicas, eletrosferas iguais às dos gases nobres.
Há três tipos de ligações químicas:- Ligação Iônica – perda ou ganho de elétrons.
- Ligação Covalente – compartilhamento de elétrons.
- Ligação Metálica – átomos neutros e cátions mergulhados numa "nuvem" de elétrons.
LIGAÇÃO IÔNICA
A ligação iônica é resultado da alteração entre íons de cargas elétricas contrárias (ânions e cátions).Esta ligação acontece, geralmente, entre os metais e não-metais.
Metais – 1 a 3 elétrons na última camada; tendência a perder elétrons e formar cátions. Elementos mais eletropositivos ou menos eletronegativos.
Não-Metais – 5 a 7 elétrons na última camada; tendência a ganhar elétrons e formar ânions. Elementos mais eletronegativos ou menos eletropositivos.
Então:
METAL + NÃO-METAL → LIGAÇÃO IÔNICA
Exemplo: Na e Cl
Na (Z = 11) K = 2 L = 8 M = 1
Cl (Z = 17) K = 2 L = 8 M = 7
O Na quer doar 1 é → Na+ (cátion)
O Cl quer receber 1 é → Cl – (ânion)
O cloro quer receber 7é na última camada. Para ficar com 8é (igual aos gases nobres) precisa de 1é.
Na+ Cl – → NaCl
cátion ânion cloreto de sódio
As ligações iônicas formam compostos iônicos que são constituídos de cátions e ânions. Tais compostos iônicos formam-se de acordo com a capacidade de cada átomo de ganhar ou perder elétrons. Essa capacidade é a valência.
Observe a tabela com a valência dos elementos químicos (alguns alcalinos, alcalinos terrosos, calcogênios e halogênios):
| SÍMBOLO | ELEMENTO QUÍMICO | CARGA ELÉTRICA |
| Na | SÓDIO | +1 |
| K | POTÁSSIO | +1 |
| Mg | MAGNÉSIO | +2 |
| Ca | CÁLCIO | +2 |
| Al | ALUMÍNIO | +3 |
| F | FLÚOR | -1 |
| Cl | CLORO | -1 |
| Br | BROMO | -1 |
| O | OXIGÊNIO | -2 |
| S | ENXOFRE | -2 |
| SÍMBOLO | ELEMENTO QUÍMICO | CARGA ELÉTRICA |
| Fe | FERRO | +2 |
| Fe | FERRO | +3 |
| Ag | PRATA | +1 |
| Zn | ZINCO | +2 |
Exemplo: Mg e Cl
Mg+2 Cl 1- → MgCl2
cátion ânion cloreto de magnésio
Pode-se utilizar a “Regra da Tesoura”, onde o cátion passará a ser o número de cloros (não-metal) na fórmula final e o ânion será o número de magnésio (metal).
Outro exemplo: Al e O
Al +3 O -2 → Al2O3
cátion ânion óxido de alumínio
Neste caso, também foi utilizada a “Regra da Tesoura”.
A fórmula final será chamada de íon fórmula.
Fórmula Eletrônica / Teoria de Lewis
A fórmula eletrônica representa os elétrons nas camadas de valência dos átomos.
Ex. NaCl
A fórmula eletrônica é também chamada de fórmula de Lewis por ter sido proposta por esse cientista.
Isomeria - 3 ano Química
Algumas substâncias podem apresentar a mesma fórmula molecular e possuir propriedades e nome diferentes.
Veja dois exemplos de substâncias químicas que possuem a mesma fórmula molecular, mas diferem no nome e em algumas propriedades:

Fórmula molecular: C2H6O
Nome: etanol
Função: álcool
Ponto de fusão: -115°C
Ponto de ebulição: 78°C
Reatividade: alta
Estado físico a 25°C: líquido
 Fórmula molecular: C2H6O
Fórmula molecular: C2H6O
Nome: metóxi-metano
Função: éter
Ponto de fusão: -140°C
Ponto de fusão: -24°C
Reatividade: baixa
Estado físico a 25°C: gás
Veja o outro exemplo análogo:
Que palavras você poderia escrever com as letras RMAO com diferentes arrumações?
Poderíamos escrever as palavras: amor e roma.
O mesmo acontece com as substâncias. Para este fenômeno, que é tão comum, damos o nome de ISOMERIA.
Isomeria – é o fenômeno que ocorrem entre moléculas com mesma fórmula molecular mas diferem na sua estrutura, propriedade e nome.
Os compostos que sofrem este tipo de fenômeno são chamados de isômeros. A palavra isômero deriva de dois radicais gregos: iso, que significa igual e meros, que significa partes.
A isomeria pode ser dividida em:
- isomeria plana (cadeia, posição, metameria, função e tautomeria)
- isomeria espacial (geométrica cis-trans e óptica)
Dividem-se em isomeria plana de cadeia, posição, metameria, função e tautomeria.
Exemplos:

Exemplos:
- diferença na posição dos radicais:
 - diferença na posição da insaturação:
- diferença na posição da insaturação:
 - diferença na posição do grupo funcional:
- diferença na posição do grupo funcional:

- álcool e éter
- aldeído e cetona
- ácido carboxílico e éter
Exemplos:
- álcool e éter: C2H6O
 - aldeído e cetona: C3H6O
- aldeído e cetona: C3H6O
 - ácido carboxílico e éster: C4H8O2
- ácido carboxílico e éster: C4H8O2

Veja dois exemplos de substâncias químicas que possuem a mesma fórmula molecular, mas diferem no nome e em algumas propriedades:

Fórmula molecular: C2H6O
Nome: etanol
Função: álcool
Ponto de fusão: -115°C
Ponto de ebulição: 78°C
Reatividade: alta
Estado físico a 25°C: líquido
Nome: metóxi-metano
Função: éter
Ponto de fusão: -140°C
Ponto de fusão: -24°C
Reatividade: baixa
Estado físico a 25°C: gás
Veja o outro exemplo análogo:
Que palavras você poderia escrever com as letras RMAO com diferentes arrumações?
Poderíamos escrever as palavras: amor e roma.
O mesmo acontece com as substâncias. Para este fenômeno, que é tão comum, damos o nome de ISOMERIA.
Isomeria – é o fenômeno que ocorrem entre moléculas com mesma fórmula molecular mas diferem na sua estrutura, propriedade e nome.
Os compostos que sofrem este tipo de fenômeno são chamados de isômeros. A palavra isômero deriva de dois radicais gregos: iso, que significa igual e meros, que significa partes.
A isomeria pode ser dividida em:
- isomeria plana (cadeia, posição, metameria, função e tautomeria)
- isomeria espacial (geométrica cis-trans e óptica)
ISOMERIA PLANA
É a isomeria onde os compostos são identificados por meio de suas fórmulas estruturais planas.Dividem-se em isomeria plana de cadeia, posição, metameria, função e tautomeria.
ISOMERIA PLANA DE CADEIA
Esta isomeria ocorre quando isômeros pertencem à mesma função, mas diferem no tipo de cadeia carbônica.Exemplos:

ISOMERIA PLANA DE POSIÇÃO
Esta isomeria ocorre entre isômeros que pertenem à mesma função, possuem o mesmo tipo de cadeia, mas diferem na posição dos radicais, insaturações ou dos grupos funcionais.Exemplos:
- diferença na posição dos radicais:



ISOMERIA DE FUNÇÃO
Esta isomeria ocorre quando os isômeros pertencem a funções diferentes. Os isômeros mais comuns para este tipo de isomeria são: - álcool e éter
- aldeído e cetona
- ácido carboxílico e éter
Exemplos:
- álcool e éter: C2H6O



Termoquímica - 2 ano Química
As transformações físicas e as reações químicas quase sempre estão envolvidas em perda ou ganho de calor. O calor é uma das formas de energia mais comum que se conhece.
A Termoquimica é uma parte da Química que faz o estudo das quantidades de calor liberadas ou absorvidas durante as reações químicas. A maioria das reações químicas envolve perda ou ganho de calor (energia).
Veja no quadro abaixo os tipos de reações com perda ou ganho de calor:
As transformações físicas também são acompanhadas de calor, como ocorre na mudanda de estados físicos da matéria.

liberação de calorQuando a substância passa do estado físico sólido para liquido e em seguida para gasoso, ocorre absorção de calor.
Quando a substância passa do estado gasoso para líquido e em seguida para líquido, ocorre liberação de calor.
Essa energia que vem das reações químicas é decorrente de rearranjo das ligações químicas dos reagentes transformando-se em produtos. Essa energia armazenada é a ENTALPIA (H). É a energia que vem de dentro da molécula.
Nas reações químicas não é necessário calcular a entalpia. Devemos calcular, geralmente, a variação de entalpia (ΔH).
A variação de entalpia é a diferença entre a entalpia dos produtos e a entalpia dos reagentes.


 Tipos de Reações
Tipos de Reações
As reações químicas podem ser de dois tipos:
- ENDOTÉRMICA: absorvem calor (+)
- EXOTÉRMICA: liberam calor (-)
A Termoquimica é uma parte da Química que faz o estudo das quantidades de calor liberadas ou absorvidas durante as reações químicas. A maioria das reações químicas envolve perda ou ganho de calor (energia).
Veja no quadro abaixo os tipos de reações com perda ou ganho de calor:
| REAÇÕES QUE LIBERAM ENERGIA | REAÇÕES QUE ABSORVEM ENERGIA |
| Queima do carvão | Cozimento de alimentos |
| Queima da vela | Fotossíntese das plantas, o sol fornece energia |
| Reação química em uma pilha | Pancada violenta inicia a detonação de um explosivo |
| Queima da gasolina no carro | Cromagem em para-choque de carro, com energia elétrica |
absorção de calor


SÓLIDO LÍQUIDO GASOSO

liberação de calor
Quando a substância passa do estado gasoso para líquido e em seguida para líquido, ocorre liberação de calor.
Essa energia que vem das reações químicas é decorrente de rearranjo das ligações químicas dos reagentes transformando-se em produtos. Essa energia armazenada é a ENTALPIA (H). É a energia que vem de dentro da molécula.
Nas reações químicas não é necessário calcular a entalpia. Devemos calcular, geralmente, a variação de entalpia (ΔH).
A variação de entalpia é a diferença entre a entalpia dos produtos e a entalpia dos reagentes.

UNIDADE DE CALOR
As reações químicas podem ser de dois tipos:
- ENDOTÉRMICA: absorvem calor (+)
- EXOTÉRMICA: liberam calor (-)
Reprodução ssexuada - Biologia
A reprodução sexuada está relacionada com processos que envolvem troca e mistura de material genético entre indivíduos de uma mesma espécie. Os indivíduos que surgem por reprodução sexuada assemelham-se aos pais, mas não são idênticos a eles.
Esse modo de reprodução, apesar de mais complexo e energicamente mais custoso do que a reprodução assexuada, traz grandes vantagens aos seres vivos e é o mais amplamente empregado pelos diferentes grupos. Mesmo organismos que apresentam reprodução assexuada podem também se reproduzir sexuadamente, embora existam algumas espécies em que a reprodução sexuada não ocorre.
Se o nosso ambiente fosse completamente estável, sem sofrer alterações ao longo do tempo, a reprodução assexuada seria muito vantajosa, pois preservaria, sem modificações, as características dos organismos para uma certa condição ecológica. Essa, entretanto, não é realidade. O meio ambiente sempre pode apresentar alterações. Sobreviver a elas depende em grande parte de o patrimônio genético conter soluções as mais variadas possíveis.


Coloração é um tipo de variabilidade.
Populações formadas por indivíduos geneticamente idênticos, como os originados por reprodução assexuada, são mais suscetíveis a alterações ambientais. Se ocorrer no ambiente uma modificação que lhes seja desfavorável, todos os indivíduos podem morrer de uma vez só. Isso pode não acontecer com populações formadas por indivíduos que se reproduzem sexuadamente, pois a variabilidade genética entre eles é maior. Essa alteração ambiental pode afetar parte da população, mas outra parte sobrevive por ter em seu material genético condições para resistir à alteração.
Na agricultura, utiliza-se muito a reprodução assexuada das plantas visando à manutenção, ao longo das gerações, de características comercialmente importantes. O uso desse recurso, no entanto, permite que culturas inteiras possam ser dizimadas caso ocorra no meio alguma alteração que prejudique esses organismos.

Nos animais, a reprodução sexuada envolve a meiose, cujos produtos são sempre os gametas, células reprodutivas haplóides. Os gametas masculinos são os espermatozóides e os femininos, os óvulos.
Na maioria dos animais, os espermatozóides são produzidos pelo indivíduo do sexo masculino e os óvulos são produzidos pelo indivíduo do sexo feminino. Nesses casos, os sexos são separados. Alguns animais, no entanto, como é o caso das minhocas, são hermafroditas, pois óvulos e espermatozóides são produzidos pelo mesmo indivíduo.
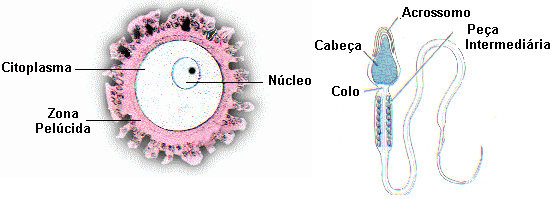
Nos hermafroditas pode ocorrer autofecundação, ou seja, a fecundação do óvulo pelo espermatozóide do mesmo indivíduo. Ocorre em algumas espécies vegetais. Entretanto, geralmente existem mecanismos que impedem a autofecundação. Nesses casos, os óvulos de um indivíduo são fecundados pelos espermatozóides de outro indivíduo da mesma espécie. Fala-se, então, em fecundação cruzada.
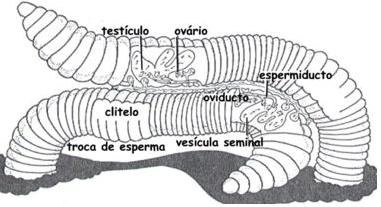
As minhocas fazem fecundação cruzada






Tipos de fecundação
A fecundação pode ser externa, quando ocorre fora do corpo, no meio ambiente, ou interna, quando, ocorre no corpo do indivíduo que produz os óvulos.

Algumas espécies de anfíbios possuem a fecundação externa. O macho estimula a fêmea a liberar os óvulos no ambiente e o macho libera os espermatozóides em cima deles.
O custo energético da produção de gametas é especialmente grande nas espécies cuja fecundação é externa. Nesses casos formam-se muitos gametas masculinos e femininos, o que garante a chance de encontro casual entre eles, originando o maior número de zigotos. Porém, desses inúmeros zigotos, nem todos sobrevivem às adversidades do meio ambiente. Apenas um pequeno número forma indivíduos adultos, dando continuidade à espécie.

Nos animais em que a fecundação é interna, o número de gametas produzidos é menor, com isso, o custo energético de sua produção também é menor. O custo com o desenvolvimento do embrião também depende do animal ser ovíparo, ovovivíparo ou vivíparo.
Animais ovíparos botam ovos e o desenvolvimento embrionário deles ocorre principalmente fora do corpo materno. Os embriões dependem de material nutritivo presente nos ovos. Como exemplo de animal ovíparo podemos citar as aves, insetos, répteis e mamíferos monotremados.


Animais ovovivíparos retêm os ovos dentro do corpo até a eclosão, e os embriões também se alimentam das reservas nutritivas presentes nos ovos. Como exemplo de animal ovovivíparo temos os lebistes, que são peixes comuns em água doce, escorpiões, tubarões e cobras venenosas.


Lebiste Víbora
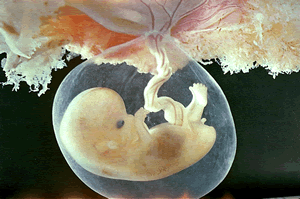
Nos vivíparos o embrião depende diretamente da mãe para a sua nutrição, que ocorre por meio de trocas fisiológicas entre mãe e feto. Não existe casca isolando o ovo. Como regra o desenvolvimento embrionário se completa dentro do corpo materno e os indivíduos já nascem formados. O custo energético é especialmente alto, pois as fêmeas investem energia na nutrição e no desenvolvimento do embrião dentro de seus corpos. Nos casos dessas espécies, forma-se um maior número de embriões, mas eles têm maiores chances de sobrevivência. É vivípara, por exemplo, os mamíferos placentários, como é o caso da espécie humana.
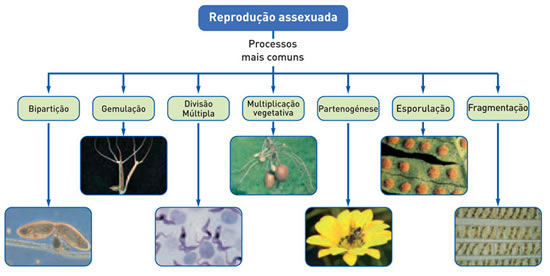
Reprodução assexuada - Biologia
Os indivíduos que surgem por reprodução assexuada são geneticamente idênticos entre si, formando o que se chama clone. Esses indivíduos só terão patrimônio genético diferente se sofrem mutação gênica, ou seja, alteração nas seqüências de bases nitrogenadas de uma ou mais moléculas de DNA.
Vários são os seres vivos que se reproduzem assexuadamente e vários são os tipos de reprodução assexuada.
Nos eucariontes, unicelulares ou multicelulares, a reprodução assexuada está relacionada com a mitose.
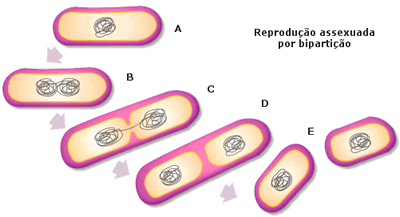
No caso dos unicelulares, o tipo de reprodução assexuada que lhes permite se dividir em dois é denominado bipartição.
O processo de bipartição também ocorre nos procariontes, mas nesse caso, não há mitose como a verificada nos eucariontes.
Nos organismos multicelulares, como as plantas, por exemplo, a reprodução assexuada pode ocorrer por propagação vegetativa. Nesse caso, partes da planta podem dar origem, por mitose, a outros indivíduos.
Conhecendo essas peculiaridades das plantas, o ser humano aprendeu a fazer uso dela, em benefício próprio, confeccionando mudas, que cultivadas, dão origem a nova planta idêntica, a planta mãe, preservando, assim, as características comercialmente importantes.
Nos animais, um dos tipos de reprodução assexuada mais frequentemente observado é o brotamento ou gemiparidade: de um indivíduo inicial brota outro indivíduo, que pode se destacar do primeiro e passar a ter vida independente. É o que acontece, por exemplo, na hidra. Em outros casos, o brotamento pode dar origem a uma colônia de organismos, em que os brotos permanecem ligados ao indivíduo inicial e se desenvolvem ligados. É o que ocorre na maioria das esponjas. A hidra, um organismo aquático, é um exemplo de animal que apresenta esse tipo de reprodução.
terça-feira, 4 de outubro de 2011
Assinar:
Postagens (Atom)