TRABALHO MUITOOOOO BACANA
quinta-feira, 29 de setembro de 2011
terça-feira, 27 de setembro de 2011
segunda-feira, 19 de setembro de 2011
Aromatizador de Ambientes
| ||
| Aplicação: Perfumar todos os cantinhos de sua casa sem gastar muito dinheiro. | ||
| Lista de Produtos • frasco com borrifador • 2ml de essência à base de álcool • 80ml de álcool etílico 96º • 18ml de água deionizada • corante hidrossolúvel | ||
| Como fazer: | ||
 1. Comece despejando no frasco a água deionizada. 1. Comece despejando no frasco a água deionizada. | ||
 2. Em seguida, adicione o álcool etílico e algumas gotas de corante. 2. Em seguida, adicione o álcool etílico e algumas gotas de corante. | ||
 3. Despeje por último a essência que você desejar dentro do frasco,misture bem e 3. Despeje por último a essência que você desejar dentro do frasco,misture bem eencaixe o borrifador. | ||
 4. Para finalizar este rápido trabalho, chacoalhe bem o frasco, 4. Para finalizar este rápido trabalho, chacoalhe bem o frasco, O seu aromatizador de ambientes está pronto! | ||
| fonte: Revista Ganhe Dinheiro autora: Ana Paula Brasil |
terça-feira, 13 de setembro de 2011
segunda-feira, 12 de setembro de 2011
Sabonete - Trabalho de Química
Confira abaixo os materiais necessários para produção de sabonete artesanal.
- 10ml de hidratante de aveia
- 3 colheres (sopa) de aveia
- 1 colher
- 1 panela de aço inox
- 150 gramas de glicerina branca
- 10ml da essência desejada
- 1 forma de silicone para sabonete especial
- 1 faca
Passo-a-passo
- 1° Passo: Com a faca, pique 150 gramas de glicerina branca.
- 2° Passo: Coloque a glicerina picada na panela e leve ao fogo baixo, mexa pouco, e quando a glicerina atingir o estado líquido, retire do fogo.
- 3° Passo: Acrescente as 3 colheres de aveia e mexa.
- 4° Passo: Depois de misturado, coloque 10ml de essência e os 10ml de hidratante de aveia, mexa até conter consistência de mingau.
- 5° Passo: Despeje na fôrma e espere secar.
- 6° Passo: Depois que estiver fria, desinforme.
Sabonete - Trabalho de Química
Anticelulite (sabonete 1)
Material
150 g de glicerina leitosa ou transparente
1/2 colher (sopa) de argila verde
4 ml de extrato glicólico de hera
4 ml de extrato glicólico de centella asiática
4 ml de essência de algas
Corante verde à base de água a gosto
Álcool de cereais
Fôrma de silicone texturizada
Gasto: R$ 2
Venda: R$ 6
Clareador de manchas (sabonete 2)
Material
100 g de glicerina leitosa
3 ml de extrato glicólico de pepino
3 ml de essência de maçã-verde
Corante verde à base de água a gosto
Fôrma redonda de PVC
Álcool de cereal
Gasto: R$ 1
Venda: R$ 3
Antiacne (sabonete 3)
Material
100 g de glicerina transparente
1 colher (sopa) de calêndula desidratada
3 ml de extrato glicólico de calêndula
3 ml de essência de calêndula
Fôrma quadrada de PVC
Gasto: R$ 1,50
Venda: R$ 4
Modo de fazer
Para estes três sabonetes, a fórmula é a mesma. Ponha a glicerina picada num recipiente plástico. Coloque em banho-maria ou leve ao micro-ondas por períodos de 15 segundos até ficar líquida. Adicione os ingredientes um a um (menos o álcool) e misture. Despeje na fôrma, borrife álcool, deixe secar e desenforme.
Sabonete - Trabalho de Química
| |
| Sabonete de Tangerina com efeito mesclado Este sabonete tem um efeito de cor mesclada, que fica muito bonito. Ingredientes: 200 g de base de glicerina transparente, 20 g de base de glicerina verde, 3 ml de essência de tangerina, forma de silicone com formato de tangerina, álcool de cereais, medidores, espátula, panela esmaltada e faca Modo de Fazer: 1 - Em panelas diferentes derreta as glicerinas em banho-maria, 2 - coloque as glicerinas derretidas em copos descartáveis separados 3 - No copo com glicerina transparente, acrescente a essência de tangerina misturando bem. 4 - E despeje esta glicerina no molde de silicone, até mais da metade da altura 5 - em seguida despeje lentamente a glicerina verde sobre o molde, com movimentos circulares, 6 - aguarde secar por 3 horas e retire da forma. 7 - deixe secar naturalmente até endurecer completamente. 8 - Envolva os sabonetes com filme pvc, para manter a umidade. |
Sabonetes caseiros - Receita e DICAS IMPORTANTES - Trabalho de Química
| ||
| Modo de Fazer: | ||
| Prepare a Glicerina cortando em em pedaços pequenos. Derretendo no microondas: Coloque no copo graduado e leve ao microondas em potência alta. O tempo será determinado pela quantidade que você for utilizar. Por exemplo, para cada 100 gr de glicerina, coloque 15 segundos, abra o microondas e verifique se já está liquida. Se necessário, vá colocando mais 10 segundos por vez, até atingir o ponto. Importante: Não deixe ferver pois a glicerina perde a transparência. Derretendo em banho-maria:Deixe em banho-maria na panela de ágata até derreter a glicerina. Não deixe a temperatura da água muito quente, para evitar que a glicerina ferva. Retire do forno e espere esfriar. Perfumar e Colorir Espere esfriar um pouco para perfumar e colorir. coloque o corante aos poucos até atingir a cor desejada Caso não faça isso a essência e o extrato (se estiver usando) irá evaporar e seu sabonete não ficará perfumado. Adicione a essência e mexa com o bastão de vidro. Evite mexer muito pois poderá fazer espuma. Segure com o bastão de vidro a película que se forma e despeje o líquido na forma escolhida. Espere secar por mais ou menos 30 minutos (depende da quantidade utilizada) e desenforme. Se necessário retire as rebarbas com uma faca sem serra. | ||
| Sabonetes Decorativos: Para decoração, no caso dos sabonetes em formato de doces, derreta 10 gr de glicerina, espere esfriar um pouco e jogue aos poucos sobre o sabonete já desenformado, dando a forma de calda escorrida. Espere umas duas horas antes de embrulhar os sabonetes. Coloque em cestinhas, caixas ou sacos de celofane. | ||
| Dicas Úteis: 1- Procure combinar os corantes com as essências, pois fica mais fácil na hora de identificar. Por exemplo: Azul: Jaborandi ou Algas Marinhas Vermelho: Rosas ou Ylang-Ylang Amarelo: Camomila ou Maracujá Laranja: Flor de laranjeira ou Pêssego Verde: Maçã Verde ou Erva Cidreira Rosa: Baby ou Mamy Lilás: Jasmim 2- Não coloque os sabonetes para secar na geladeira ou ao vento, pois a base transpirará. 3- Evite deixar cair a nata que se formou no derretimento , segurando com uma colher. Assim o sabonete ficará mais liso. 4- Ao enformar os sabonetes, borrife mais um pouco de álcool de cereais para retirar a espuma que se formou e evitar a formação de bolhas. Se a espuma não sair, retire com auxilio de uma faca. A película que se forma, não é necessário tirar, pois logo se formará outra. 5- A espuma ou a camada esbranquiçada que se forma, não deve ser reaproveitada. Já as rebarbas ou sabonetes que não ficaram ao seu gosto, podem ser derretidas novamente. 6- Não utilize materiais de alumínio ou teflon, pois pode oxidar e alterar a cor dos sabonetes, além causar alergias. 7- Não tenha pressa em desenformar os sabonetes. Se eles não estiverem bem rígidos, seu trabalho pode ficar comprometido. Mas se alguma coisa der errado, não se aborreça e comece novamente reaproveitando a peça comprometida.  Sabonetes feitos com fundo de garrafas de plástico Sabonetes feitos com fundo de garrafas de plástico 8- Use sua criatividade na hora de escolher as formas. Até o fundo de uma garrafa de refrigerante descartável dará um belo sabonete massageador. Procure no meio dos brinquedos das crianças ou em lojas de artigos culinários que com certeza você encontrará muitas idéias diferentes. 9- Você pode usar formas de acetato (aquelas usadas para chocolate) que são bem mais baratas que as de silicone. Porém elas têm um tempo de uso pequeno (no máximo 8 vezes) e as de silicone são de uso indeterminado e bem mais fáceis de desenformar. |
Sache do Amor para Perfumar - Trabalho de Química
| |
| Aplicação: Coloque o sachê nas gavetas de roupas para deixá-las bem perfumadas. | |
| Lista de Produtos • 50g de glicerina branca (veja a Base hipoalergênica MA) • 1,5ml de essência de alecrim (veja as Essências MA) • corante hidrossolúvel vermelho (veja os Corantes p/Cosméticos MA) • molde de silicone em formato de coração (veja os Moldes MA) • copo béquer de 250ml • bastão de vidro • embalagem de pachtwork ou saco de Tule • panela esmaltada | |
| Como fazer o Sabonete: | |
 1. Derreta a glicerina, em banho-maria, na panela esmaltada. Coloque-a no copo béquer e adicione o corante e a essência. 1. Derreta a glicerina, em banho-maria, na panela esmaltada. Coloque-a no copo béquer e adicione o corante e a essência. | |
 2. Despeje na forma, espere secar por 20 minutos e desenforme. Coloque os corações na embalagem. 2. Despeje na forma, espere secar por 20 minutos e desenforme. Coloque os corações na embalagem. | |
| Pronto. Agora use o Amor no seu sabonete !!! | |
| fonte: Revista Sabonetes Artesanais autora: Iolanda Pires |
Sabonete Líquido Perolado Trabalho de Química
| Aplicação: Para presente, vender ou uso próprio. |
| Lista de Materiais • 50ml de base ou concentrado de xampu • 10ml de base perolada • 150ml de água destilada • 10ml de extrato vegetal de aveia • 1ml de Bactericida • 10ml de essência Gabriela Sabatine ou similar • Corantes para Sabonetes na cor preferida • Frasco com válvula para saboneteira • colher de plástico ou bastão de vidro |
| Como fazer o Sabonete líquido Cremoso: 1ª parte |
 1. Num recipiente, coloque a água destilada 1. Num recipiente, coloque a água destilada |
 2. Agora, sempre mexendo: Acrescente aos poucos, a base para xampu, a base perolada, o extrato, a essência, o corante 2. Agora, sempre mexendo: Acrescente aos poucos, a base para xampu, a base perolada, o extrato, a essência, o corante e por último o bactericida. |
Sabonete Líquido Bifásico - Trabalho de química
| Coloque no seu lavado e surpreenda suas visitas. Atice a curiosidade das visitas, elas vão querer saber como vc fez !!! |
| Aplicação: Presente, venda ou uso próprio. |
| Lista de Materiais • 200ml de base ou concentrado de xampo • 6ml de essência Love Spill Vic. Secrets ou similar • Corantes para Sabonetes Verde e Laranja • Frasco com válvula para saboneteira • 500ml de água destilada ou filtrada • colher de plástico ou bastão de vidro • panela esmaltada |
| Como fazer o Sabonete líquido: 1ª parte |
| Fazendo a 1ª fase: Cor Laranja |
 1. Num recipiente, coloque 100ml de base ou concentrado de xampo. 1. Num recipiente, coloque 100ml de base ou concentrado de xampo. |
 2. Em seguida, acrescente aos poucos, 200ml de água e mexa até ficar bem homogêneo 2. Em seguida, acrescente aos poucos, 200ml de água e mexa até ficar bem homogêneo |
Sabonete Banana Esfoliante - Trabalho de Química
| Aplicação e Uso: Parece inusitado e estranho misturar banana e aveia em um mesmo sabonete. Será? Vamos ver o que resulta esta mistura... Esta mistura gera um ótimo esfoliante e pode ser usado como amaciante da pele, renovando as células e dermes. |
| Como fazer - 1ª parte |
| Lista de Produtos • 50g de base de glicerina branca • 150g de base de glicerina transparente • 1 cortador de inox redondo (para biscoito) • 5 ml de Essência de Banana • Sementes pretas de gergelim • 3 gotas de corante hidrossolúvel marfim • Molde retangular de PVC, silicone ou metal • panela esmaltada • bastão de vidro e 1 faca |
 1. Corte a glicerina branca em fatias e com o cortador inox, faça pressão sobre a glicerina para fazer as 1. Corte a glicerina branca em fatias e com o cortador inox, faça pressão sobre a glicerina para fazer as |
Sabonete - Trabalho de Química
| Prática receita usando o microondas. É fácil e rápido. É outra maneira de fazer. |
| Como fazer o Sabonete: |
 Lista de Produtos • base de glicerina a gosto (veja a Base hipoalergênica MA) Lista de Produtos • base de glicerina a gosto (veja a Base hipoalergênica MA)• Vidro refratário • corante hidrossolúvel a gosto • Essência a gosto (veja as Essências MA) • bastão de vidro • Molde para sabonete (de silicone ou pvc ou metal) Obs: Se for de metal revestir com filme pvc. |
 1. Corte a glicerina em pedaços pequenos. Coloque no vidro refratário e coloque no microondas 1. Corte a glicerina em pedaços pequenos. Coloque no vidro refratário e coloque no microondas Dicas: Regule o tempo para 30 segs, qdo o micro ondas apitar, mexa a glicerina com bastão de vidro. Dependendo do seu modelo de microondas, vc deve repetir esta operação algumas vezes. Lembre-se que quando começar a derreter, a glicerina se dissolve rápido. Portanto ao mexer, repare se os pedaços já estão derretidos. Não precisa esquentar muito. (se tem termômetro, a temperatura deve ser até 60º) Quando estiver quase tudo derretido, não use mais o microondas, pois as moléculas continuam vibrando mesmo fora do microondas. E o derretimento será total. Mexa bem com o bastão até ficar líquido e uniforme. Deixe esfria um pouco (em torno dos 50º) |
Ligações químicas - 1° ano
Uma ligação iônica ocorre quando um ou mais elétrons são transferidos da camada de valência (A última camada que contém elétrons) de um átomo para a camada de valência de outro. Se um átomo perde elétrons torna-se um íon positivo (cátion), enquanto o átomo que ganha elétrons torna-se negativamente carregado (ânion). A ligação iônica resulta da atração entre os íons com cargas opostas.
Então, conclui-se que um gás de íons sódio e cloro totalmente separados tem energia mais alta que um gás de átomos de sódio e cloro, entretanto, devido à forte atração eletrostática, os íon se juntam para formar um sólido cristalino e sua atração mútua libera uma grande quantidade de energia: A ligação covalente é caracterizada pelo compartilhamento de um ou mais pares de elétrons entre átomos, causando uma atração mútua entre eles, que mantêm a molécula resultante unida. Átomos tendem a compartilhar elétrons de modo que suas camadas eletrônicas externas sejam preenchidas e eles adquiram uma distribuição eletrônica mais estável. A força dessas ligações é maior que a das interações intermoleculares e comparável à da ligação iônica.
Esse tipo de ligação tende a ser mais forte que outros tipos de ligações, como a iônica. Ao contrário das ligações iônicas, nas quais os íons são mantidos unidos por atração coulômbica não direcional, ligações covalentes são altamente direcionais. Como resultado, Moléculas covalentemente ligadas tendem a formar-se em um número relativamente pequeno de formas características, exibindo ângulos de ligação específicos.
Ligações Iônicas são um tipo de ligação química baseada na atração eletrostática entre dois íons carregados com cargas opostas. Na formação da ligação iônica, um metal doa um elétron, devido a sua baixa eletronegatividade formando um íon positivo ou cátion. No sal de cozinha, as ligações entre os íons sódio e cloreto são iônicas. Geralmente ligações iônicas se formam entre um metal e um ametal. O átomo do ametal tem uma configuração eletrônica semelhante a de um gás nobre, quase totalmente preenchida de elétrons. Eles tem alta eletronegatividade, e facilmente ganham elétrons formando um íon negativo ou ânion. Os dois ou mais íons logo se atraem devido a forças eletrostáticas. Ligações desse tipo são mais fortes que ligações de hidrogênio, mas tem força similar às ligações covalentes.

 A ligação iônica ocorre somente se a variação da energia total da reação é favorável -- quando os átomos ligados tem energia mais baixa que os átomos livres. Quanto maior a variação da energia total, mais forte se torna a ligação.
A ligação iônica ocorre somente se a variação da energia total da reação é favorável -- quando os átomos ligados tem energia mais baixa que os átomos livres. Quanto maior a variação da energia total, mais forte se torna a ligação.
Estudos revelaram que não existe ligação iônica pura. Todas ligações iônicas tem um grau de ligação covalente ou ligação metálica. Quanto maior a diferença na eletronegatividade entre dois átomos mais iônica se torna a ligação. Compostos iônicos conduzem eletricidade quando fundidos ou em solução. Eles geralmente tem um alto ponto de fusão e tendem a ser solúveis em água.

Configuração Eletrônica de lítio e fluor. O Lítio tem um elétron
em sua camada de valência, mantido com dificuldade porque
sua energia de ionização é baixa.
O Fluor possui 7 elétrons em sua camada de valência.
Quando um elétron se move do lítio para o fluor, cada íon
adquire a configuração de gás nobre.
A energia de ligação proveniente da atração eletrostática
dos dois íons de cargas opostas tem valor negativo
suficiente para que a ligação se torne estável.

Imagem de dois íons, por exemplo Na+ e Cl- formando uma ligação iônica.
Os orbitais eletrônicos geralmente não se sobrepõem
(i.e., orbitais moleculares não são formados), devido ao fato
de que cada íon chega ao estado energético mais baixo e a
ligação é baseada somente (teoricamente) em interações
eletrostáticas entre os íons positivo e negativo.Essa polarização do íon negativo leva a criação de uma densidade de carga extra entre os dois núcleos atômicos, i.e., a covalência parcial. Íons negativos grandes são mais facilmente polarizados, mas normalmente o efeito só tem relevância quando íons positivos com cargas de 3+ (ex., Al3+) estão envolvidos (ex., AlCl3 puro é uma molécula covalente). No entanto, íons com carga 2+ (Be2+) ou até com carga 1+ (Li+) demonstram algum grau de polarização devido a seu pequeno raio atômico (ex., LiI é iônico mas tem algum caráter covalente).
O Grau de Polarização depende da relação de carga e do tamanho do íon, geralmente chamada de densidade de carga.
Quando todos os íons tem aproximadamente o mesmo tamanho, eles podem formar uma estrutura diferente chamada cúbica de face-centrada (onde a massa é 4 * massa atômica), mas, quando os íons tem tamanhos diferentes, a estrutura é geralmente cúbica de corpo-centrado (2 vezes a massa). Em retículos iônicos o número de coordenação se refere ao número de íons que cada retículo está ligado.
As ligações iônicas são ligações químicas entre átomos que possuem grande diferença de eletronegatividade.
O funcionamento desta ligação baseia-se na transferência de elétrons de um átomo para outro, sendo a causa desta transferência de elétrons a eletronegatividade, propriedade atômica de natureza eletrostática e que indica a força com a qual o núcleo atrai a eletrosfera e, assim, a força com a qual ele segura seus elétrons e tendência para adquirir outros.
Ela é formada a partir da doação de um ou mais elétrons do elemento menos eletronegativo para o mais eletronegativo, gerando assim cargas de sinais opostos em ambos os átomos, que se atraem fortemente e ficando tão próximos quanto a repulsão entre os núcleos e entre as eletrosferas permite. A força com que eles se atraem é tamanha que, para separá-los sem dissolvê-los em água (fusão), a energia necessária é suficiente para elevar a temperatura do composto para algo em torno de 700ºC ou mais. As substâncias ionicas geralmente possuem maior ponto de fusão.
Exemplo: ligaçãoentre alumínio e oxigênio
 Note que o número de átomos do metal pode ser diferente do não-metal, pois o total das cargas dos cátions deve ser igual a dos ânions.
Note que o número de átomos do metal pode ser diferente do não-metal, pois o total das cargas dos cátions deve ser igual a dos ânions.
Fórmula de Lewis: representa os elementos pelos elétrons da última camada (elétrons de valência).
 Características dos Compostos iônicos: em condições ambientes, são sólidos, cristalinos, duros, com elevados pontos de fusão e ebulição. No estado sólido, não conduzem eletricidade, mas quando fundidos ou em solução aquosa, são bons condutores, pois os íons ficam livres para se moverem.
Características dos Compostos iônicos: em condições ambientes, são sólidos, cristalinos, duros, com elevados pontos de fusão e ebulição. No estado sólido, não conduzem eletricidade, mas quando fundidos ou em solução aquosa, são bons condutores, pois os íons ficam livres para se moverem.
Podemos exemplificar a ligação iônica com um caso típico entre dois átomos hipotéticos - um metal M e um ametal X: como M é um metal, sua energia de ionização é baixa, isto é, é necessário pouca energia para remover um elétron do átomo M. A perda de um elétron por um átomo leva à formação de um íon positivo (cátion). Por outro lado, como X é um ametal, sua afinidade eletrônica é negativa, isto é, possui uma grande tendência em ganhar elétrons e formar um íon negativo (ânion). Se estes processos são interligados, ou seja, se o elétron perdido por M é ganho por X, então todo o processo pode ser representado por:
M M+ + e-
Cl + e- Cl -
M + X M+ + Cl -
Para se formar uma ligação iônica, é necessário que os átomos de um dos elementos tenham tendência a ceder elétrons e os átomos do outro elemento tenham tendência a receber elétrons.
Quando os átomos de dois elementos A e B têm ambos tendência a ceder ou a receber elétrons, não pode se formar uma ligação iônica entre eles.
Os átomos com tendência a ceder elétrons apresentam um, dois ou três elétrons na camada da valência; são todos átomos de metais, com exceção dos átomos de H e He. Os átomos com tendência a receber elétrons apresentam quatro, cinco, seis e sete elétrons na camada da valência; são os átomos dos não-metais e do H.
Uma ligação iônica forma-se entre um metal e um não-metal ou entre um metal e o H. Os elétrons são transferidos dos átomos dos metais para os dos não-metais ou do H.
Os átomos dos metais, cedendo elétrons, transformam-se em íons positivos ou cátions, e os átomos dos não-metais ou do H, recebendo elétrons, transformam-se em íons negativos ou ânions.
Todo ânion monoatômico tem configuração estável, semelhante à de um gás nobre, porque, na formação do ânion, o átomo recebe exatamente o número de elétrons que falta para ser atingida a configuração estável.
Nem todo cátion monoatômico tem configuração estável. O átomo, ao ceder os elétrons de sua camada da valência , nem sempre fica com configuração estável.
Os cátions dos metais alcalinos e alcalino-terrosos, bem como o cátion de alumínio, têm configurações estáveis. Os cátions dos metais de transição não têm, em sua maioria, configuração estável.
Valência é o poder de combinação dos elementos. O conceito de valência foi criado por Berzelius, em 1820.
Eletrovalência é a valência do elemento na forma iônica. É igual à carga do seu íon monoatômico.
A ligação metálica explica a condutividade elétrica, a maleabilidade, a ductilidade e outras propriedades dos metais.
Eletronegatividade de um elemento é uma medida da sua capacidade de atrair os elétrons das ligações covalentes das quais ele participa.
Quanto maior for a capacidade de um átomo de atrair os elétrons das ligações covalentes das quais ele participa, maior será a sua eletronegatividade.
Ligação covalente polar é aquela que constitui um dipolo elétrico. Forma-se quando as eletronegatividades dos elementos ligados são diferentes.
Ligação covalente apolar é aquela que não constitui dipolo elétrico. Neste caso, as eletronegatividades dos átomos ligados são iguais.
Poucas ligações são totalmente iônicas, covalentes ou metálicas, existindo na maioria das vezes uma ligação intermediária entre estes três tipos de ligações, onde haverá características de duas delas ou até mesmo das três.
Tomando-se como exemplo a formação de cloreto de sódio, têm-se as equações termoquímicas dos ionizações:
- Na (Sódio) possui 1 elétron na camada de valência (M).
- Cl (Cloro) possui 7 elétrons na camada de valência (M).
- Na doa seu elétrom (M=1) para Cl (M=7).
- Na passa a ter 8 elétrons na camada L, ficando assim estável.
- Cl passa a ter 8 elétrons na camada M, ficando também estável.
- Na agora fica positivo por 'PERDER' um elétron.
- Cl agora fica negativo por 'GANHAR' um elétron.
Observação
Ao contrário de que muitos pensam de, se está ganhando fica positivo, e se está perdendo negativo, está errado, no caso das Ligações Iônicas funciona como uma balança, quando ele perde algum peso (perder um elétrom) a balança levanta, ficando mais alta (ficando positivo), quando ele ganha um peso (ganhar um elétron) ele abaixa (ficando negativo).Então, conclui-se que um gás de íons sódio e cloro totalmente separados tem energia mais alta que um gás de átomos de sódio e cloro, entretanto, devido à forte atração eletrostática, os íon se juntam para formar um sólido cristalino e sua atração mútua libera uma grande quantidade de energia: A ligação covalente é caracterizada pelo compartilhamento de um ou mais pares de elétrons entre átomos, causando uma atração mútua entre eles, que mantêm a molécula resultante unida. Átomos tendem a compartilhar elétrons de modo que suas camadas eletrônicas externas sejam preenchidas e eles adquiram uma distribuição eletrônica mais estável. A força dessas ligações é maior que a das interações intermoleculares e comparável à da ligação iônica.
Ligação Covalente
Ligações covalentes normalmente ocorrem entre átomos com eletronegatividades similares e altas (geralmente entre dois metais), dos quais remover completamente um elétron requer muita energia.Esse tipo de ligação tende a ser mais forte que outros tipos de ligações, como a iônica. Ao contrário das ligações iônicas, nas quais os íons são mantidos unidos por atração coulômbica não direcional, ligações covalentes são altamente direcionais. Como resultado, Moléculas covalentemente ligadas tendem a formar-se em um número relativamente pequeno de formas características, exibindo ângulos de ligação específicos.
Ligações Iônicas são um tipo de ligação química baseada na atração eletrostática entre dois íons carregados com cargas opostas. Na formação da ligação iônica, um metal doa um elétron, devido a sua baixa eletronegatividade formando um íon positivo ou cátion. No sal de cozinha, as ligações entre os íons sódio e cloreto são iônicas. Geralmente ligações iônicas se formam entre um metal e um ametal. O átomo do ametal tem uma configuração eletrônica semelhante a de um gás nobre, quase totalmente preenchida de elétrons. Eles tem alta eletronegatividade, e facilmente ganham elétrons formando um íon negativo ou ânion. Os dois ou mais íons logo se atraem devido a forças eletrostáticas. Ligações desse tipo são mais fortes que ligações de hidrogênio, mas tem força similar às ligações covalentes.
Estudos revelaram que não existe ligação iônica pura. Todas ligações iônicas tem um grau de ligação covalente ou ligação metálica. Quanto maior a diferença na eletronegatividade entre dois átomos mais iônica se torna a ligação. Compostos iônicos conduzem eletricidade quando fundidos ou em solução. Eles geralmente tem um alto ponto de fusão e tendem a ser solúveis em água.

Configuração Eletrônica de lítio e fluor. O Lítio tem um elétron
em sua camada de valência, mantido com dificuldade porque
sua energia de ionização é baixa.
O Fluor possui 7 elétrons em sua camada de valência.
Quando um elétron se move do lítio para o fluor, cada íon
adquire a configuração de gás nobre.
A energia de ligação proveniente da atração eletrostática
dos dois íons de cargas opostas tem valor negativo
suficiente para que a ligação se torne estável.
Efeitos da Polarização
Os íons em cristais de compostos puramente iônicos são esféricos, mas, se o íon positivo é pequeno e/ou altamente carregado, será distorcida a nuvem eletrônica do íon negativo.
Imagem de dois íons, por exemplo Na+ e Cl- formando uma ligação iônica.
Os orbitais eletrônicos geralmente não se sobrepõem
(i.e., orbitais moleculares não são formados), devido ao fato
de que cada íon chega ao estado energético mais baixo e a
ligação é baseada somente (teoricamente) em interações
eletrostáticas entre os íons positivo e negativo.
O Grau de Polarização depende da relação de carga e do tamanho do íon, geralmente chamada de densidade de carga.
Estrutura Iônica
Compostos iônicos no estado sólido formam uma estrutura iônica contínua em um cristal iônico. A forma mais simples de cristal iônico é um cúbico simples. Nessa forma todos os átomos estão posicionados nas extremidades de um cubo. Essa célula unitária tem a massa que é a mesmo de 1 dos átomos envolvidos.Quando todos os íons tem aproximadamente o mesmo tamanho, eles podem formar uma estrutura diferente chamada cúbica de face-centrada (onde a massa é 4 * massa atômica), mas, quando os íons tem tamanhos diferentes, a estrutura é geralmente cúbica de corpo-centrado (2 vezes a massa). Em retículos iônicos o número de coordenação se refere ao número de íons que cada retículo está ligado.
Ligações iônicas versus ligações covalentes
Em uma ligação iônica, os átomos estão ligados pela atração de íons com cargas opostas, enquanto que em uma ligação covalente, os átomos estão ligados por compartilhar elétrons. Na ligação covalente, a geometria molecular de cada átomo é determinada pelas regras da VSEPR (Valence Shell Electron Pair Repulsion Theory), enquanto que, em materiais iônicos, a geometria segue as regras do empacotamento máximo.As ligações iônicas são ligações químicas entre átomos que possuem grande diferença de eletronegatividade.
O funcionamento desta ligação baseia-se na transferência de elétrons de um átomo para outro, sendo a causa desta transferência de elétrons a eletronegatividade, propriedade atômica de natureza eletrostática e que indica a força com a qual o núcleo atrai a eletrosfera e, assim, a força com a qual ele segura seus elétrons e tendência para adquirir outros.
Ela é formada a partir da doação de um ou mais elétrons do elemento menos eletronegativo para o mais eletronegativo, gerando assim cargas de sinais opostos em ambos os átomos, que se atraem fortemente e ficando tão próximos quanto a repulsão entre os núcleos e entre as eletrosferas permite. A força com que eles se atraem é tamanha que, para separá-los sem dissolvê-los em água (fusão), a energia necessária é suficiente para elevar a temperatura do composto para algo em torno de 700ºC ou mais. As substâncias ionicas geralmente possuem maior ponto de fusão.
Para reconhecer um composto iónico, devem-se analisar as seguintes características do mesmo:
Ponto de fusão elevado
- Conduz corrente elétrica no estado líquido ou quando dissolvido em agua
- Possui brilho
- Não conduz corrente elétrica no estado sólido
- É solúvel em água
Observação
Como este tipo de ligação ocorre entre elementos com grande diferença de eletronegatividade, um método prático, mas passível de exce(p)ções, é analisar se a estrutura tem um metal ligado a um ametal. Se for o caso, é grande a possibilidade desta ser uma ligação iónica. Mas o reconhecimento destas substâncias é feito em laboratório, analisando-se suas propriedades físico-químicas citadas.Fonte: pt.wikipedia.org
LIGAÇÕES IÔNICAS
Ligação Iônica ou Eletrovalente
Ligação entre íons por fortes forças eletrostáticas em que um metal doa elétrons para um não-metal, formando cátion (íon positivo) e ânions (íon negativo), respectivamente. Os compostos iônicos (aqueles que apresentam ligação iônica) são eletricamente neutros.Exemplo: ligaçãoentre alumínio e oxigênio

Fórmula de Lewis: representa os elementos pelos elétrons da última camada (elétrons de valência).

Fonte: www.ficharionline.com
LIGAÇÕES IÔNICAS
Uma ligação iônica envolve forças eletrostáticas que atraem íons de cargas opostas. Esse tipo de ligação geralmente ocorre entre um átomo ou agrupamento de átomos que tem tendência a ceder elétrons e um átomo ou agrupamento de átomos que tem tendência a receber elétrons. Os compostos iônicos em geral apresentam altos pontos de fusão e ebulição, são sólidos duros e quebradiços e solubilizam-se facilmente em solventes polares.Podemos exemplificar a ligação iônica com um caso típico entre dois átomos hipotéticos - um metal M e um ametal X: como M é um metal, sua energia de ionização é baixa, isto é, é necessário pouca energia para remover um elétron do átomo M. A perda de um elétron por um átomo leva à formação de um íon positivo (cátion). Por outro lado, como X é um ametal, sua afinidade eletrônica é negativa, isto é, possui uma grande tendência em ganhar elétrons e formar um íon negativo (ânion). Se estes processos são interligados, ou seja, se o elétron perdido por M é ganho por X, então todo o processo pode ser representado por:
M M+ + e-
Cl + e- Cl -
M + X M+ + Cl -
A formação de um composto iônico
A energia de ionização e a afinidade eletrônica são estabelecidas partindo de átomos isolados, no estado gasoso. No entanto, os processos que envolvem a formação de íons gasosos geralmente não são encontrados. Assim, vamos considerar a formação de cloreto de bário a partir dos estados físicos em que as substâncias bário e cloro são normalmente encontradas.Os processos envolvidos podem ser sintetizados num esquema denominado ciclo de Born-Haber. Veja:
- DHs - Entalpia de sublimação
- DHd - Entalpia de dissociação
- DHei - Energia de ionização
- DHae - Afinidade eletrônica
- DHUo - Energia reticular
Fonte: www.geocities.com
LIGAÇÕES IÔNICAS
Tipos de ligações
Os átomos podem adquirir uma configuração eletrônica estável de três maneiras: perdendo, recebendo ou compartilhando elétrons.Os elementos formados por uma destas maneiras recebe uma classificação:
- elementos eletropositivos, cujos átomos perdem um ou mais elétrons com relativa facilidade
- elementos eletronegativos, que tendem a receber elétrons
- elementos com reduzida tendência em perder ou receber elétrons.
Ligação Iônica
Ligação iônica ou eletrovalente é a atração eletrostática entre íons de cargas opostas num retículo cristalino. Esses íons formam-se pela transferência de elétrons dos átomos de um elemento para os átomos de outro elemento.Para se formar uma ligação iônica, é necessário que os átomos de um dos elementos tenham tendência a ceder elétrons e os átomos do outro elemento tenham tendência a receber elétrons.
Quando os átomos de dois elementos A e B têm ambos tendência a ceder ou a receber elétrons, não pode se formar uma ligação iônica entre eles.
Os átomos com tendência a ceder elétrons apresentam um, dois ou três elétrons na camada da valência; são todos átomos de metais, com exceção dos átomos de H e He. Os átomos com tendência a receber elétrons apresentam quatro, cinco, seis e sete elétrons na camada da valência; são os átomos dos não-metais e do H.
Uma ligação iônica forma-se entre um metal e um não-metal ou entre um metal e o H. Os elétrons são transferidos dos átomos dos metais para os dos não-metais ou do H.
Os átomos dos metais, cedendo elétrons, transformam-se em íons positivos ou cátions, e os átomos dos não-metais ou do H, recebendo elétrons, transformam-se em íons negativos ou ânions.
Todo ânion monoatômico tem configuração estável, semelhante à de um gás nobre, porque, na formação do ânion, o átomo recebe exatamente o número de elétrons que falta para ser atingida a configuração estável.
Nem todo cátion monoatômico tem configuração estável. O átomo, ao ceder os elétrons de sua camada da valência , nem sempre fica com configuração estável.
Os cátions dos metais alcalinos e alcalino-terrosos, bem como o cátion de alumínio, têm configurações estáveis. Os cátions dos metais de transição não têm, em sua maioria, configuração estável.
Valência é o poder de combinação dos elementos. O conceito de valência foi criado por Berzelius, em 1820.
Eletrovalência é a valência do elemento na forma iônica. É igual à carga do seu íon monoatômico.
Ligação Covalente
Ligação covalente é um par de elétrons compartilhado por dois átomos, sendo um elétron de cada átomo participante da ligação.Ligação Dativa
Ligação dativa ou coordenada é um par de elétrons compartilhado por dois átomos, no qual os dois elétrons são fornecidos apenas por um dos átomos participantes da ligação. Forma-se quando um dos átomos já tem o seu octeto completo e o outro ainda não.Ligação Metálica
Ligação metálica é constituída pelos elétrons livres que ficam entre os cátions dos metais (modelo do gás eletrônico ou do mar de elétrons). Os metais são constituídos por seus cátions mergulhados em um mar de elétrons.A ligação metálica explica a condutividade elétrica, a maleabilidade, a ductilidade e outras propriedades dos metais.
Eletronegatividade de um elemento é uma medida da sua capacidade de atrair os elétrons das ligações covalentes das quais ele participa.
Quanto maior for a capacidade de um átomo de atrair os elétrons das ligações covalentes das quais ele participa, maior será a sua eletronegatividade.
Ligação covalente polar é aquela que constitui um dipolo elétrico. Forma-se quando as eletronegatividades dos elementos ligados são diferentes.
Ligação covalente apolar é aquela que não constitui dipolo elétrico. Neste caso, as eletronegatividades dos átomos ligados são iguais.
Poucas ligações são totalmente iônicas, covalentes ou metálicas, existindo na maioria das vezes uma ligação intermediária entre estes três tipos de ligações, onde haverá características de duas delas ou até mesmo das três.
Fonte: www.mundodoquimico.hpg.ig.com.br
Ligações químicas - 1° ano
Alguns compostos não precisam ter oito elétrons na camada de valência para atingir a estabilidade, são por isso considerados exceções à Regra do Octeto. Aprenda agora por que alguns elementos escapam da obrigação de ter um octeto de elétrons na última camada.
Berílio (Be)
É uma exceção à Regra do Octeto porque é capaz de formar compostos com duas ligações simples, sendo assim, estabiliza-se com apenas quatro elétrons na camada de valência.

Como o hidrogênio (H) precisa ceder dois elétrons para realizar a ligação (H ― Be ― H), o átomo de Berílio (Be) compartilha seus elétrons e atinge a estabilidade.
Alumínio (Al)
É uma exceção à Regra do Octeto porque atinge a estabilidade com seis elétrons na camada de valência. O átomo de Alumínio tende a doar seus elétrons e assim pode formar três ligações simples com outros átomos:
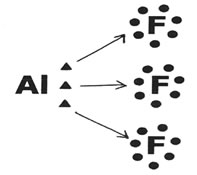
Neste caso, o Alumínio (Al) formou três ligações com três átomos de Flúor (F).
Boro (B)
Forma substâncias moleculares com três ligações simples.
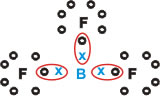
Repare que o Boro (B) tem a tendência de doar seus elétrons para os átomos de Flúor (F), este sim obedece à Regra do Octeto, necessitando de oito elétrons na camada de valência. Como o Boro cede seus elétrons, o flúor se estabiliza com o Octeto formado.
Por Líria Alves
Graduada em Química
Equipe Brasil Escola
Berílio (Be)
É uma exceção à Regra do Octeto porque é capaz de formar compostos com duas ligações simples, sendo assim, estabiliza-se com apenas quatro elétrons na camada de valência.

Como o hidrogênio (H) precisa ceder dois elétrons para realizar a ligação (H ― Be ― H), o átomo de Berílio (Be) compartilha seus elétrons e atinge a estabilidade.
Alumínio (Al)
É uma exceção à Regra do Octeto porque atinge a estabilidade com seis elétrons na camada de valência. O átomo de Alumínio tende a doar seus elétrons e assim pode formar três ligações simples com outros átomos:

Neste caso, o Alumínio (Al) formou três ligações com três átomos de Flúor (F).
Boro (B)
Forma substâncias moleculares com três ligações simples.

Repare que o Boro (B) tem a tendência de doar seus elétrons para os átomos de Flúor (F), este sim obedece à Regra do Octeto, necessitando de oito elétrons na camada de valência. Como o Boro cede seus elétrons, o flúor se estabiliza com o Octeto formado.
Por Líria Alves
Graduada em Química
Equipe Brasil Escola
segunda-feira, 5 de setembro de 2011
Assinar:
Postagens (Atom)

