Escrito por: Miguel A. Medeiros
Publicado em: 04 de julho de 2004
Qual a semelhança entre a cerveja, o vinho, a vodka, a cachaça, o licor e o álcool combustível para automóveis?
A semelhança é o constituinte principal, o álcool etílico, ou etanol. Mas o que é etanol?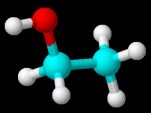
A semelhança é o constituinte principal, o álcool etílico, ou etanol. Mas o que é etanol?

O etanol, CH3CH2OH, é um dos principais álcoois que existem, sendo ele incolor, inflamável e de odor característico. Ele é miscível em água e em outros compostos orgânicos. Seu ponto de fusão é em -114,1°C e seu ponto de ebulição é em 78,5°C.
O etanol ou álcool etílico pode ser obtido através da fermentação dos açúcares. Este é o método mais comum no Brasil, que utiliza a cana-de-açúcar para obter os açúcares que darão origem ao etanol. Este álcool é o que se encontra em todas as bebidas alcoólicas, assim como no álcool combustível e na gasolina, como um aditivo.
O etanol pode ser obtido também, pela fermentação de cereais, tais como a cevada e o malte. A cerveja é obtida pela fermentação de cereais.
O etanol pode ser obtido também, pela fermentação de cereais, tais como a cevada e o malte. A cerveja é obtida pela fermentação de cereais.
A fermentação ocorre com a adição de fermento biológico a uma mistura de água e açúcares. O fermento por possuir enzimas de levedura que convertem açúcar em álcool, é o responsável pelas reações de transformação de glicose a etanol. Estas reações podem ser simplificadas como a seguir:
C6H12O6(aq) à 2 CH3CH2OH(aq) + 2 CO2(g)
| Enzimas à proteínas com propriedade de catalisar determinadas reações em organismos vivos, a partir de reações bioquímicas. |
No processo de fermentação de açúcares para obter bebidas alcoólicas, não ocorre a produção de bebidas com alto teor alcoólico. Em bebidas com elevado teor alcoólico é necessário um processo de destilação da solução e isso é o que ocorre na produção de cachaça, por exemplo.
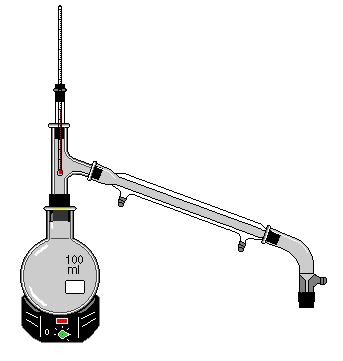
A cachaça ou também conhecida como aguardente é uma bebida que passa pelo processo de destilação, utilizando o alambique, aparelho que serve como um destilador fracionado, desenvolvido pelos alquimistas, na época medieval.
No processo de destilação da cachaça, utilizando o alambique, ocorre a produção de várias frações da bebida, com diversificados teores alcoólicos.
No processo de destilação da cachaça, utilizando o alambique, ocorre a produção de várias frações da bebida, com diversificados teores alcoólicos.

No caso do álcool combustível ou do de uso doméstico, a destilação também ocorre, pois estes possuem alto teor alcoólico, geralmente acima de 85%. No Brasil, nos dias atuais, início de 2004, não deveria ser encontrado mais, álcool de uso doméstico com teor alcoólico tão elevado. Isso, devido ao seu uso inadequado, que provocava muitos casos de queimaduras graves em pessoas descuidadas.
Algumas marcas de álcool comercializado com finalidade de uso doméstico possuem teor alcoólico, em torno de 46% m/m (46° INPM) de álcool, que está sendo encontrado em forma de solução e em gel (neste caso o teor alcoólico é de 65%).

Algumas marcas de álcool comercializado com finalidade de uso doméstico possuem teor alcoólico, em torno de 46% m/m (46° INPM) de álcool, que está sendo encontrado em forma de solução e em gel (neste caso o teor alcoólico é de 65%).
| O que significa teor de 46% m/m? Bem, isso significa que em 100 g de solução, 46 g é de álcool e o restante é de água. |
Entretanto, ainda existe no comércio o produto com teor alcoólico de 92,8% de álcool (graças a uma liminar concedida a alguns produtores), um teor muito elevado para a sua finalidade. A Anvisa (Agência Nacional de Vigilância Sanitária) em uma resolução de fevereiro de 2002 (resolução RDC nº 46, de 20 de fevereiro de 2002), mostra-se contra este tipo de produto, com alta concentração alcoólica. No banco de dados da Agência não foi encontrado nenhuma outra resolução que revogasse a anteriormente citada, apenas a informação sobre a liminar.
liminar concedida a alguns produtores), um teor muito elevado para a sua finalidade. A Anvisa (Agência Nacional de Vigilância Sanitária) em uma resolução de fevereiro de 2002 (resolução RDC nº 46, de 20 de fevereiro de 2002), mostra-se contra este tipo de produto, com alta concentração alcoólica. No banco de dados da Agência não foi encontrado nenhuma outra resolução que revogasse a anteriormente citada, apenas a informação sobre a liminar.
Os álcoois combustíveis e de uso doméstico possuem teor alcoólico superior a de bebidas, no entanto, estes álcoois não podem ser ingeridos, pois possuem aditivos, conhecidos como agentes desnaturantes, que são responsáveis pela alteração do gosto do álcool, para evitar que sejam ingeridos. Alguns agentes desnaturantes, utilizados: metanol, etanal e benzoato de denatônio.
sejam ingeridos. Alguns agentes desnaturantes, utilizados: metanol, etanal e benzoato de denatônio.
O etanol pode ser obtido de outras formas, como por exemplo, a partir da hidratação do eteno, catalisado por ácido sulfúrico. A seguir, a reação simplificada de hidratação do eteno.
| CH2=CH2 | | CH3-CH2-OH |
O etanol, além de ser utilizado em bebidas alcoólicas, ele é muito empregado na indústria, seja na farmacêutica (na produção de perfumes, loções, anti-sépticos, etc) ou como solvente químico.